 Pavel Kroupka 08.01.2022
Pavel Kroupka 08.01.2022 Fale materii - opis cząstek elementarnych
Pomysł aby obiekty materialne opisywać za pomocą fal pochodzi od Louisa de Broglie’a. To on zainspirowany pracami Einsteina na temat efektu fotoelektrycznego wpadł na pomysł uzupełniający falowo-korpuskularne relacje. Skoro światło będąc w oczywistych swych aspektach falą może być też traktowane jako strumień energetycznych kwantów (fotonów), dlaczego zatem elementarnych cząstek materii nie postrzegać w formie i charakterze struktur falowych?
Hipoteza de Broglie’a
Taką właśnie hipotezę postawił de Broglie - z każdą cząstką skorelowana jest odpowiednia fala. Fala taka może być traktowana jako forma uzupełnienia wyjaśnienia zachowania danej cząstki. Długość takiej fali (nazywana długością de Broglie’a) jest odwrotnie proporcjonalna do pędu cząstki, co opisać można wzorem ƛ=h/p, gdzie h jest stałą Plancka. Zatem im mniejszy jest pęd cząstki tym dłuższa fala opisuje daną cząstkę, co z kolei przekłada się na coraz bardziej wyraźne zobrazowanie jej falowej natury. Należy zaznaczyć, iż dla de Broglie'a fale materii nie były konstruktem teoretycznym; były one tak samo rzeczywiste jak typowo fizyczne wielkości określające daną cząstkę, np. jej masa.
Doświadczalne potwierdzenie istnienia fal materii
Teoretyczne wywody de Broglie’a potwierdzone zostały doświadczalnie przez Clintona Davissona i Lestera Germera w 1927 roku. Eksperyment polegał na naświetlaniu wiązką elektronów płaszczyzny kryształu niklu i rejestracji rozkładu cząstek po kontakcie z siatką krystaliczną w zależności od kąta padania wiązki elektronów. Emitowane elektrony były przyspieszane za pomocą odpowiedniego napięcia ulegając dyfrakcji podczas kontaktu ze strukturą krystaliczną niklu. Dla określonego napięcia stwierdzono maksimum natężenia rozproszonej wiązki. Maksimum utożsamiono ze zjawiskiem interferencja fal materii skorelowanych z elektronami, które uginały się na atomach tworzących siatkę monokryształu. Wyników eksperymentu nie dało się wytłumaczyć na gruncie fizyki ruchu cząstek elementarnych, lecz tylko dzięki teorii falowej, co niniejszym potwierdzało intuicję de Broglie’a. Probabilistyczną interpretację fal materii zaproponował Max Born. Jego zdaniem opisane doświadczenie było absolutnym dowodem na to, że elektrony odbijają się od struktury kryształu tak jak fale. Davisson i Germer, którzy początkowo nie zdawali sobie sprawy z wagi wyników przeprowadzonych eksperymentów, powtórzyli badania pod kątem uwag poczynionych przez Borna. Okazało się, iż zachowanie elektronów podczas przejścia przez strukturę siatki krystalicznej niklu odpowiada zachowaniu fal o długości równej długości de Broglie’a.
Wnioski z eksperymentu potwierdzone zostały doświadczeniem Thomsona, który przepuszczał wiązki elektronów przez cienkie folie polikrystaliczne (substancje zbudowane z przypadkowo zorientowanych kryształów niewielkich rozmiarów). Także w tym przypadku wystąpiła dyfrakcja dokładnie potwierdzająca teorię de Broglie’a.
Zgodność z modelem Bohra
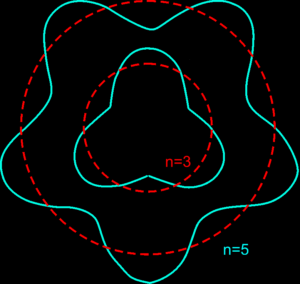
Fale materii znalazły od razu swoje teoretyczne zastosowanie w ramach wyjaśnienia koncepcji orbit stacjonarnych w modelu atomu opracowanym przez Bohra. Przypomnijmy, iż aby wyjaśnić wyniki prowadzonych doświadczeń Niels Bohr autorytarnie w spreparowanym przez siebie modelu przyjął koncepcję istnienia stanów stacjonarnych elektronów - istnienia orbit, na których elektron jest stabilny i nie wypromieniowuje energii. De Broglie zaproponował, by dla elektronów możliwe były tylko te orbity, dla których fala gładko łączy się ze sobą po wykonaniu przez elektron pełnego okrążenia jądra atomowego. Elektron krążący po orbicie ze stałą prędkością jest tu reprezentowany przez określoną falę materii. Każdy kolejny okres obiegu ulega dokładnemu powtórzeniu, co oznacza zgodność fazy poszczególnych fal. Długość fali de Broglie’a jest określona w taki sposób, aby orbita o danym promieniu zawierała całkowitą liczbę fal materii. Zatem możliwe orbity muszą na swym obwodzie mieścić całkowitą wielokrotność długości fal de Broglie'a. Taki obraz sytuacji ewokuje obraz stojących fal materii, co prowadzi do kwantyzacji długości fal będących konsekwencją nałożonych ograniczeń. Ponieważ fale stojące nie przenoszą energii elektron na orbicie stacjonarnej nie emituje promieniowania, co zgadzało się z pomysłem zaproponowanym przez Bohra.
Nowy opis świata cząstek
Postulat występowania fal materii przyniósł wytłumaczenie konieczności istnienia danych orbit stacjonarnych i stworzył fundamenty teorii opisu stanów atomowych. Ciągle jednak otwartą kwestią pozostawał sposób rozchodzenia się tych fal oraz jaką funkcją należy je opisać. Nad odpowiedziami pracowali już inni fizycy - Erwin Schrödinger sformułował równanie falowe, które uogólniały fale materii de Broglie’a. Zaproponowany został nowy sposób opisu świata cząstek elementarnych - mechanika kwantowa.
Świat fizyki został zdominowany przez badania i odkrycia na płaszczyźnie kwantowej. Za odkrycie falowej natury elektronu de Broglie otrzymał w roku 1929 nagrodę Nobla, Schrödinger cztery lata później, Davisson w roku 1937, a Max Born w 1954. Choć de Broglie, podobnie jak Einstein, nie akceptował probabilistycznej interpretacji fal materii zaproponowanej przez Borna, podążanie w takim właśnie kierunku było dla fizyki nieuniknione.
 info@iviter.pl
info@iviter.pl








Napisz komentarz (bez rejestracji)